Blog
Terminología Básica Metabolismo Celular
20.11.2013 14:01REDUCCION-OXIDACION
Es toda reacción química en la que uno o más electrones se transfieren entre los reactivos, provocando un cambio en sus estados de oxidación.
Para que exista una reacción de reducción-oxidación, en el sistema debe haber un elemento que ceda electrones, y otro que los acepte:
Ø El agente oxidante es el elemento químico que tiende a captar esos electrones, quedando con un estado de oxidación inferior al que tenía, es decir, siendo reducido.
Ø El agente reductor es aquel elemento químico que suministra electrones de su estructura química al medio, aumentando su estado de oxidación, es decir, siendo oxidado.
Ø Cuando un elemento químico reductor cede electrones al medio, se convierte en un elemento oxidado, y la relación que guarda con su precursor queda establecida mediante lo que se llama un par redox. Análogamente, se dice que, cuando un elemento químico capta electrones del medio, este se convierte en un elemento reducido, e igualmente forma un par redox con su precursor oxidado.
Oxidaciones y Reducciones Biológicas
En el metabolismo de todos los seres vivos, los procesos redox tienen una importancia capital, ya que están involucrados en la cadena de reacciones químicas de la fotosíntesis y de la respiración aeróbica. En ambas reacciones existe una cadena transportadora de electrones formada por una serie de complejos enzimáticos, entre los que destacan los citocromos; estos complejos enzimáticos aceptan (se reducen) y ceden (se oxidan) pares de electrones de una manera secuencial, de tal manera que el primero cede electrones al segundo y éste al tercero, hasta un aceptor final que se reduce definitivamente; durante su viaje, los electrones van liberando energía que se aprovecha para sintetizar enlaces de alta energía en forma de ATP.
Otro tipo de reacción redox fundamental en los procesos metabólicos son las deshidrogenaciones, en las cuales un enzima (deshidrogenasa) arranca un par de átomos de hidrógeno a un sustrato; dado que el átomo de hidrógeno consta de un protón y un electrón, dicho sustrato se oxida (pierde electrones). Dichos electrones son captados por moléculas especializadas, principalmente las coenzimas NAD+, NADP+ y FAD que al ganar electrones se reducen, y los conducen a las cadenas transportadoras de electrones antes mencionadas.
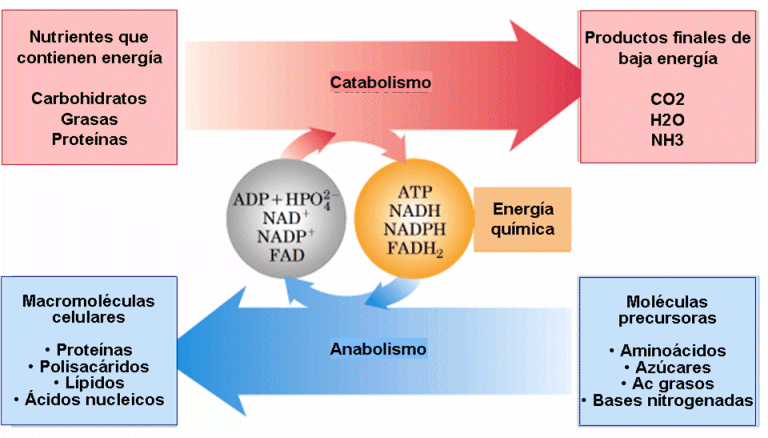
El metabolismo implica cientos de reacciones redox. Así, el catabolismo lo constituyen reacciones en que los sustratos se oxidan y las coenzimas se reducen. Por el contrario, las reacciones del anabolismo son reacciones en que los sustratos se reducen y las coenzimas se oxidan. En su conjunto, catabolismo y anabolismo constituyen el metabolismo.
ADP: Es un nucleótido difosfato, es decir, un compuesto químico formado por un nucleótido y dos radicales fosfato unidos entre sí. En este caso el nucleótido lo componen una base púrica, la adenina, y un azúcar del tipo pentosa que es la ribosa.
NAD: La dinucleótido de nicotinamida adenina (abreviada NAD+ en su forma oxidada y NADH en su forma reducida) es una coenzima que contiene la vitamina B3 y cuya función principal es el intercambio de electrones e hidrogeniones en la producción de energía de todas las células.
La Fosforilación: Es la adición de un grupo fosfato, o no fosfato molecular criogenizado inorgánico a cualquier otra molécula. Su papel predominante en la bioquímica lo convierte en un importante objeto de investigación sobre todo en la fosforilación de proteínas y de fructosa. En el metabolismo, la fosforilación es el mecanismo básico de transporte de energía desde los lugares donde se produce hasta los lugares donde se necesita. Asimismo, es uno de los principales mecanismos de regulación de la actividad de proteínas en general y de las enzimas en particular.
La fosforilación más importantes para el metabolismo es la fosforilación del ADP, es decir, la adición de un grupo fosfato al ADP para formar ATP:
ADP + P → ATP + H2O
El ATP así formado transporta la energía del enlace convirtiéndose en la moneda de cambio energética del metabolismo. Hay diversas vías que fosforilan ADP.
Fosforilación a Nivel de Sustrato
La fosforilación a nivel de sustrato es la síntesis de ATP acoplada a una reacción exergónica sin intervención de la enzima ATP-sintasa. Está mediada por enzimas quinasas y se produce, por ejemplo, en el ciclo de Krebs o en la glucólisis; constituye únicamente una pequeña parte del total de ATP producido en la célula.
Fosforilación Oxidativa
La oxidación del alimento durante la respiración libera energía química potencial que es utilizada para sintetizar ATP. El proceso implica la fosforilación oxidativa de moléculas alimenticias como glucosa, ácidos grasos o glicerina (las más comunes). Las moléculas son descompuestas durante una serie de reacciones y la energía liberada en ciertos estados del proceso es utilizada para producir ATP en reacciones de fosforilación. Se calcula que hasta el 90% de la energía celular en forma de ATP es producida de esta forma.
Fotofosforilación
Se refiere al proceso de formación del ATP durante la fase luminosa de la fotosíntesis. La energía lumínica excita y desplaza electrones de la clorofila y otros pigmentos presentes en las plantas, algas y cianobacterias. La energía asociada con los electrones excitados se almacena en el ATP en un proceso que produce más moléculas de este tipo a partir de ADP y fosfato inorgánico.
REFERENCIAS
1. Burriel Martí, Fernando; Arribas Jimeno, Siro; Lucena Conde, Felipe; Hernández Méndez, Jesús (2007). Química analítica cualitativa. Editorial Paraninfo. p. 175. ISBN 9788497321402. Consultado el 16 de octubre de 2013. «[...]
2. Química para el nuevo Milenio- 8b: Edición. Escrito por John William Hill, Doris K Kolb. Página 204.
3. Química: la ciencia central Escrito por Theodore L. Brown,Bruce E. Bursten, Julia R. Burdge. Página 128.
—————
Terminología Básica del Metabolismo
20.11.2013 11:21REDUCCIÓN-OXIDACIÓN
Es toda reacción química en la que uno o más electrones se transfieren entre los reactivos, provocando un cambio en sus estados de oxidación.
Para que exista una reacción de reducción-oxidación, en el sistema debe haber un elemento que ceda electrones, y otro que los acepte:
Ø El agente oxidante es el elemento químico que tiende a captar esos electrones, quedando con un estado de oxidación inferior al que tenía, es decir, siendo reducido.
Ø El agente reductor es aquel elemento químico que suministra electrones de su estructura química al medio, aumentando su estado de oxidación, es decir, siendo oxidado.
Ø Cuando un elemento químico reductor cede electrones al medio, se convierte en un elemento oxidado, y la relación que guarda con su precursor queda establecida mediante lo que se llama un par redox. Análogamente, se dice que, cuando un elemento químico capta electrones del medio, este se convierte en un elemento reducido, e igualmente forma un par redox con su precursor oxidado.
Oxidaciones y Reducciones Biológicas
En el metabolismo de todos los seres vivos, los procesos redox tienen una importancia capital, ya que están involucrados en la cadena de reacciones químicas de la fotosíntesis y de la respiración aeróbica. En ambas reacciones existe una cadena transportadora de electrones formada por una serie de complejos enzimáticos, entre los que destacan los citocromos; estos complejos enzimáticos aceptan (se reducen) y ceden (se oxidan) pares de electrones de una manera secuencial, de tal manera que el primero cede electrones al segundo y éste al tercero, hasta un aceptor final que se reduce definitivamente; durante su viaje, los electrones van liberando energía que se aprovecha para sintetizar enlaces de alta energía en forma de ATP.
Otro tipo de reacción redox fundamental en los procesos metabólicos son las deshidrogenaciones, en las cuales un enzima (deshidrogenasa) arranca un par de átomos de hidrógeno a un sustrato; dado que el átomo de hidrógeno consta de un protón y un electrón, dicho sustrato se oxida (pierde electrones). Dichos electrones son captados por moléculas especializadas, principalmente las coenzimas NAD+, NADP+ y FAD que al ganar electrones se reducen, y los conducen a las cadenas transportadoras de electrones antes mencionadas.
El metabolismo implica cientos de reacciones redox. Así, el catabolismo lo constituyen reacciones en que los sustratos se oxidan y las coenzimas se reducen. Por el contrario, las reacciones del anabolismo son reacciones en que los sustratos se reducen y las coenzimas se oxidan. En su conjunto, catabolismo y anabolismo constituyen el metabolismo.
ADP: Es un nucleótido difosfato, es decir, un compuesto químico formado por un nucleótido y dos radicales fosfato unidos entre sí. En este caso el nucleótido lo componen una base púrica, la adenina, y un azúcar del tipo pentosa que es la ribosa.
NAD: La dinucleótido de nicotinamida adenina (abreviada NAD+ en su forma oxidada y NADH en su forma reducida) es una coenzima que contiene la vitamina B3 y cuya función principal es el intercambio de electrones e hidrogeniones en la producción de energía de todas las células.
La Fosforilación: Es la adición de un grupo fosfato, o no fosfato molecular criogenizado inorgánico a cualquier otra molécula. Su papel predominante en la bioquímica lo convierte en un importante objeto de investigación sobre todo en la fosforilación de proteínas y de fructosa. En el metabolismo, la fosforilación es el mecanismo básico de transporte de energía desde los lugares donde se produce hasta los lugares donde se necesita. Asimismo, es uno de los principales mecanismos de regulación de la actividad de proteínas en general y de las enzimas en particular.
La fosforilación más importantes para el metabolismo es la fosforilación del ADP, es decir, la adición de un grupo fosfato al ADP para formar ATP:
ADP + P → ATP + H2O
El ATP así formado transporta la energía del enlace convirtiéndose en la moneda de cambio energética del metabolismo. Hay diversas vías que fosforilan ADP.
Fosforilación a Nivel de Sustrato
La fosforilación a nivel de sustrato es la síntesis de ATP acoplada a una reacción exergónica sin intervención de la enzima ATP-sintasa. Está mediada por enzimas quinasas y se produce, por ejemplo, en el ciclo de Krebs o en la glucólisis; constituye únicamente una pequeña parte del total de ATP producido en la célula.
Fosforilación Oxidativa
La oxidación del alimento durante la respiración libera energía química potencial que es utilizada para sintetizar ATP. El proceso implica la fosforilación oxidativa de moléculas alimenticias como glucosa, ácidos grasos o glicerina (las más comunes). Las moléculas son descompuestas durante una serie de reacciones y la energía liberada en ciertos estados del proceso es utilizada para producir ATP en reacciones de fosforilación. Se calcula que hasta el 90% de la energía celular en forma de ATP es producida de esta forma.
Fotofosforilación
Se refiere al proceso de formación del ATP durante la fase luminosa de la fotosíntesis. La energía lumínica excita y desplaza electrones de la clorofila y otros pigmentos presentes en las plantas, algas y cianobacterias. La energía asociada con los electrones excitados se almacena en el ATP en un proceso que produce más moléculas de este tipo a partir de ADP y fosfato inorgánico.
REFERENCIAS
1. Burriel Martí, Fernando; Arribas Jimeno, Siro; Lucena Conde, Felipe; Hernández Méndez, Jesús (2007). Química analítica cualitativa. Editorial Paraninfo. p. 175. ISBN 9788497321402. Consultado el 16 de octubre de 2013. «[...]
2. Química para el nuevo Milenio- 8b: Edición. Escrito por John William Hill, Doris K Kolb. Página 204.
3. Química: la ciencia central Escrito por Theodore L. Brown,Bruce E. Bursten, Julia R. Burdge. Página 128.
—————
Metabolismo REDOX
19.11.2013 21:19Papel en el metabolismo redox
Esquema simplificado del metabolismo redox, mostrando como el NAD+ y el NADH enlazan el ciclo de Krebs y la fosforilación oxidativa.
Las reacciones redox catalizadas por oxidorreductasas son vitales en todo el metabolismo, pero dentro del proceso de estas reacciones es de particular importancia la liberación de energía a partir de los nutrientes, donde los compuestos reducidos, como la glucosa, se oxidan, liberando de este modo energía, que es transferida al NAD+ mediante la reducción hacia el NADH, como parte de la glucolisis y el ciclo de Krebs. En células eucariotas, los electrones transportados por el NADH que se produce en el citoplasma por glucolisis, son transferidos al interior de la mitocondria (para reducir el NAD+ mitocondrial) por lanzaderas mitocondriales, como la lanzadera malato-aspartato. El NADH mitocondrial es entonces oxidado a su vez por la cadena de transporte de electrones, que bombea protones a lo largo de la membrana y genera ATP a través de fosforilación oxidativa. Estos sistemas de lanzadera también tienen la misma función de transporte en los cloroplastos.
Dado que las formas oxidada como reducida de la nicotinamida adenina dinucleótido son usadas en estos conjuntos enlazados de reacciones, la célula mantiene concentraciones significativas tanto de NAD+ como de NADH, con una alta proporción de NAD+/NADH que permite a esta coenzima actuar como agente oxidante y agente reductor. En contraste, la función principal del NAD+ es la de agente reductor en el anabolismo, estando la coenzima implicada en rutas como la biosíntesis de ácidos grasos y la fotosíntesis. Puesto que el NADPH es necesario para conducir las reacciones redox como un fuerte agente reductor, la proporción NADP+/NADPH se mantiene muy baja.
Aunque es importante en el catabolismo, el NADH se utiliza también en reacciones anabólicas como la gluconeogénesis. Esta necesidad de NADH en el anabolismo presenta un problema para los procariotas que crecen en nutrientes que liberan sólo una pequeña cantidad de energía. Por ejemplo, las bacterias nitrificantes como Nitrobacter oxidan el nitrito a nitrato, lo que libera energía suficiente para bombear los protones y generar ATP, pero no para producir NADH directamente. Como el NADH sigue siendo necesario para las reacciones anabólicas, estas bacterias usan un nitrito oxidorreductasa para producir suficiente fuerza motriz de protones y dirigir parte de la cadena de transporte de electrones en sentido inverso, generando NADH.
—————
Rutas Metabólicas (rutas de rescate)
19.11.2013 20:31Rutas de rescate
Además de ensamblar el NAD+ de novo a partir de aminoácidos precursores simples, las células también rescatan compuestos preformados que contienen nicotinamida. Aunque se conocen otros precursores, los tres compuestos naturales que contienen el anillo de nicotinamida y son usados en estas rutas metabólicas de rescate son el ácido nicotínico (Na), la nicotinamida (Nam) y la nicotinamida ribósido (NR). Los precursores se introducen en la ruta biosintética de NAD(P)+ (mostrada abajo) a través de reacciones de adenilación y fosforibosilación.
Estos compuestos se pueden tomar a partir de la dieta, donde la mezcla de ácido nicotínico y nicotinamida se conoce como vitamina B3 o niacina. Sin embargo, estos compuestos también son producidos en el interior de las células, cuando el grupo nicotinamida es liberado del NAD+ en las reacciones de transferencia de ADP-ribosa. De hecho, las enzimas involucradas en dichas rutas de rescate parecen estar concentradas en el núcleo celular, lo que puede compensar el alto nivel de reacciones que consumen NAD+ en este orgánulo. Las células pueden también tomar NAD+ extracelular a partir de sus alrededores.
A pesar de la presencia de la ruta de novo, las reacciones de rescate son esenciales en los seres humanos; una carencia de niacina en la dieta provoca la enfermedad de déficit vitamínico conocida como pelagra. Esta elevada exigencia de NAD+ resulta del constante consumo de la coenzima en reacciones tales como las modificaciones post-traduccionales, ya que el ciclado del NAD+ entre las forma oxidada y reducida en las reacciones redox no cambia en nada los niveles generales de la coenzima.
Las rutas de rescate utilizadas en microorganismos difieren de las usadas en mamíferos. Por ejemplo, algunos agentes patógenos, como la levadura Candida glabrata y la bacteria Haemophilus influenzae son auxótrofos de NAD+, es decir, no pueden sintetizar NAD+, pero poseen rutas de rescate y por ende son dependientes de fuentes externas de NAD+ o de sus precursores.
—————
Rutas Metabólicas
19.11.2013 20:26Rutas Metabólicas
El NAD+ se sintetiza a través de dos rutas metabólicas: ya sea una ruta de novo a partir de aminoácidos, o en rutas de rescate mediante el reciclado de componentes preformados como la nicotinamida convertida de nuevo en NAD+.
PRODUCCION DE NOVO
La mayoría de los organismos sintetizan NAD+ a partir de componentes simples. El sitio específico de la reacción es diferente entre los organismos, pero un rasgo común es la generación de ácido quinolínico (QA) a partir de un aminoácido; ya sea el triptófano (Trp) en animales y algunas bacterias, o el ácido aspártico en algunas bacterias y plantas. El ácido quinolínico se convierte en ácido nicotínico mononucleótido (NaMN) mediante la transferencia del grupo fosforibosa. Un grupo adenina es transferido entonces para formar dinucleótido de ácido adenina (NaAD). Finalmente, el grupo de ácido nicotínico en NaAD es amidado a grupo nicotinamida (Nam), formando así nicotinamida de adenina dinucleótido.
Tras esto, algunos NAD+ se convierten en NADP+ mediante la enzima NAD+ quinasa que está especializada en el, mediante la fosforilación del NAD+. En la mayoría de los organismos, esta enzima utiliza ATP como fuente del grupo fosfato, aunque en algunas bacterias, como la Mycobacterium, usan polifosfatos inorgánicos como un donante alternativo de fosforilo.
—————
Rutas Metabólicas
18.11.2013 21:47Rutas Metabólicas de la Glucosa-6-Fosfato
La glucosa-6-fosfato (también conocida como éster de Robison) es una molécula de glucosa fosforilada en el carbono 6. Es un compuesto muy común en las células, ya que la gran mayoría de glucosa que entra en la célula termina siendo fosforilada y convertida en glucosa-6-fosfato. Por ello, esta molécula presenta multitud de destinos posibles en el interior de la célula, entre los que cabe destacar dos rutas metabólicas de las más importantes:
Ø La glucólisis.
Ø La ruta de las pentosas fosfato.
Además, la glucosa-6-fosfato puede ser convertida en glucógeno o en almidón, como almacén energético depositado en el hígado o en el músculo. Se almacenará en forma glucógeno en la mayoría de los organismos pluricelulares y en forma de almidón intracelular o gránulos de glucógeno en el resto de organismos.
—————
Rutas Metabólicas de la Glucosa-6-Fosfato
18.11.2013 21:26Rutas Metabólicas de la Glucosa-6-Fosfato
La glucosa-6-fosfato (también conocida como éster de Robison) es una molécula de glucosa fosforilada en el carbono 6. Es un compuesto muy común en las células, ya que la gran mayoría de glucosa que entra en la célula termina siendo fosforilada y convertida en glucosa-6-fosfato. Por ello, esta molécula presenta multitud de destinos posibles en el interior de la célula, entre los que cabe destacar dos rutas metabólicas de las más importantes:
Ø La glucólisis.
Ø La ruta de las pentosas fosfato.
Además, la glucosa-6-fosfato puede ser convertida en glucógeno o en almidón, como almacén energético depositado en el hígado o en el músculo. Se almacenará en forma glucógeno en la mayoría de los organismos pluricelulares y en forma de almidón intracelular o gránulos de glucógeno en el resto de organismos.
—————
Citoplasma Celular
18.11.2013 12:13|
|
|
|
Dibujo esquemático de una célula eucariota con sus respectivos orgánulos.
|
El citoplasma es la parte del protoplasma que, en una célula eucariota, se encuentra entre el núcleo celular y la membrana plasmática. Consiste en una emulsión coloidal muy fina de aspecto granuloso, el citosol o hialoplasma, y en una diversidad de orgánulos celulares que desempeñan diferentes funciones
Su Función es albergar los orgánulos celulares y contribuir al movimiento de estos. El citosol es la sede de muchos de los procesos metabolicos que se dan en las células. El citoplasma es la parte del protoplasma que, en una célula eucariota, se encuentra entre el núcleo celular y la membrana plasmática. Consiste en una emulsión coloidal muy fina de aspecto granuloso, el citosol o hialoplasma, y en una diversidad de orgánulos celulares que desempeñan diferentes funciones.
El citoplasma se divide en ocasiones en una región externa gelatinosa, cercana a la membrana, e implicada en el movimiento celular, que se denomina ectoplasma; y una parte interna más fluida que recibe el nombre de endoplasma y donde se encuentran la mayoría de los orgánulos. El citoplasma se encuentra en las células procariotas así como en las eucariotas y en él se encuentran varios nutrientes que lograron atravesar la membrana plasmática, llegando de esta forma a los orgánulos de la célula.
El citoplasma de las células eucariotas está subdividido por una red de membranas (retículo endoplasmático liso y retículo endoplasmático rugoso) que sirven como superficie de trabajo para muchas de sus actividades bioquímicas.
El retículo endoplasmático rugoso está presente en todas las células eucariotas (inexistente en las procariotas) y predomina en aquellas que fabrican grandes cantidades de proteínas para exportar. Es continuo con la membrana externa de la envoltura nuclear, que también tiene ribosomas adheridos.
—————
SINTESIS DE LA GLUCOSA-6-FOSFATO
18.11.2013 00:00Síntesis de Glucosa-6-Fosfato
Desde Glucosa
En el interior de la célula, la glucosa-6-fosfato es producida por la fosforilación de la glucosa en su carbono 6. Esta reacción es catalizada por la enzima hexoquinasa en la mayoría de las células, y en los animales superiores, también por la glucoquinasa, en determinadas células como los hepatocitos (células del hígado). Esta reacción consume una molécula de ATP.
La principal razón que explica esta rápida fosforilación de la glucosa tras su entrada en la célula, es prevenir su difusión al exterior, ya que la fosforilación añade un grupo fosfato cargado que impide que la glucosa-6-fosfato pueda atravesar la membrana plasmática.
Desde Glucógeno
La glucosa-6-fosfato también puede ser producida durante la glucogenolisis, a partir de glucosa-1-fosfato, el primer producto generado en la hidrólisis de los polímeros de glucógeno.
Destino 1: Ruta de las pentosas fosfato
Cuando la tasa de NADP+: NADPH aumenta, el organismo debe promover la síntesis de NADPH, un agente reductor imprescindible en multitud de reacciones como la síntesis de ácidos grasos o la reducción de glutatión en los eritrocitos. Para ello, la glucosa-6-fosfato será deshidrogenada por medio de la enzima glucosa-6-fosfato deshidrogenasa, dando lugar a la primera reacción (reversible) de la ruta de las pentosas fosfato. Esta ruta generará más cofactor NADPH, así como ribulosa-5-fosfato, que actúa como fuente de carbono para la síntesis de otras moléculas. De igual forma, si el organismo necesita precursores de nucleótidos para la replicación del ADN o la síntesis de proteínas, la glucosa-6-fosfato también será deshidrogenada y entrará en la ruta de las pentosas fosfato.
Destino 2: Glucolisis
En el caso de que la célula necesite energía o compuestos carbonados para procesos de síntesis (anabolismo), la glucosa-6-fosfato entrará en la ruta de la glucólisis. En primer lugar, la glucosa-6-fosfato será isomerizada a fructosa-6-fosfato mediante la enzima glucosa-6-fosfato isomerasa. A continuación, sufrirá otra fosforilación que dará lugar a la fructosa-1,6-bifosfato. Este paso es irreversible y por tanto, desde este punto, el organismo se asegura la obtención de energía en forma de ATP por la ruta glucolítica.
Destino 3: Almacenaje en forma de glucógeno
Si los niveles de glucosa en sangre son elevados, el organismo activará los mecanismos necesarios para almacenar y retirar del torrente sanguíneo ese exceso de glucosa. Tras ser convertida en glucosa-6-fosfato, la glucosa-6-fosfato isomerasa la convertirá en su isómero glucosa-1-fosfato, el cual puede combinarse con UTP para formar UDP-glucosa. La UDP-glucosa es la forma activa necesaria para poder incorporarse a una molécula creciente de glucógeno, por medio de la una reacción llevada a cabo por la enzima glucógeno sintasa. Este mecanismo de almacenaje de la glucosa es muy eficiente, ya que solo es necesario consumir 1 molécula de ATP para almacenar 1 molécula de glucosa, y prácticamente ningún gasto energético para recuperarla.
Es importante señalar que la glucosa-6-fosfato es un activador alostérico de la glucógeno sintasa, lo cual tiene sentido desde el punto de vista de la regulación, ya que cuando los niveles de glucosa en sangre son altos, se debe promover el almacenaje de dicho exceso de glucosa en forma de glucógeno. Por otro lado, la glucógeno sintasa es inhibida cuando es fosforilada por una quinasa durante períodos de estrés o ante bajos niveles de glucosa en sangre (vía inducción hormonal por glucagón o adrenalina).
Cuando el organismo precisa glucosa con fines energéticos, la glucógeno fosforilasa, con la ayuda de un ortofosfato, puede hidrolizar las moléculas de glucosa del polímero de glucógeno. Cada molécula escindida lo hace en forma de glucosa-1-fosfato, que será convertida en glucosa-6-fosfato por medio de la glucosa-6-fosfato isomerasa. A continuación, el grupo fosfato de la glucosa-6-fosfato podrá ser eliminado tras la acción de la glucosa-6-fosfatasa, que dará lugar a glucosa. Esta glucosa libre podrá atravesar las membranas celulares y entrar en la corriente sanguínea para llegar a otras zonas del cuerpo.
Destino 4: Desfosforilación y Liberación a la Corriente Sanguínea
Las células hepáticas expresan la enzima glucosa-6-fosfatasa, que elimina el grupo fosfato de la glucosa-6-fosfato producida en la ruta de la glucogenolisis o de la gluconeogénesis. Esta glucosa libre pasa a la corriente sanguínea donde podrá ser utilizada por otras células del organismo.
Referencia
Berg, Jeremy M.; Tymoczko, Stryer (2002). Biochemistry (5th edición). New York: W.H. Freeman and Company.
—————





